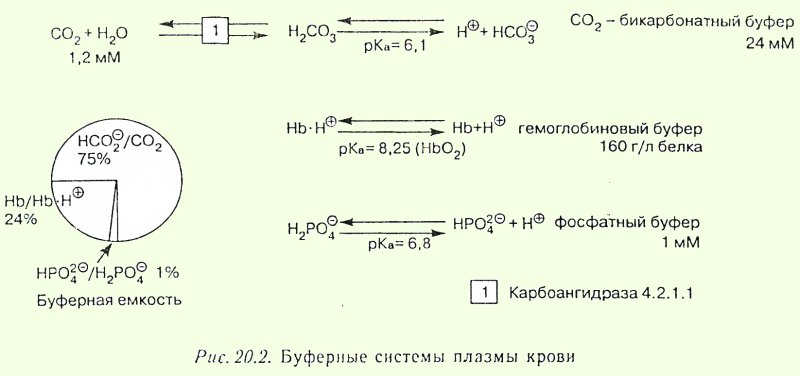
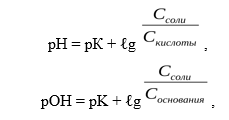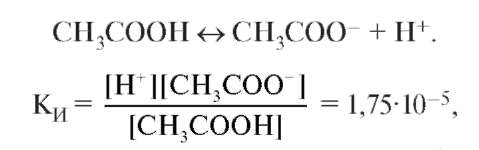Зона действия бикарбонатного буфера

Буферные растворы
Категория: Химия. Похожие презентации:. Буферные системы. Классификация буферных растворов. Кислотно-основные равновесия в водном растворе. Буферные растворы.


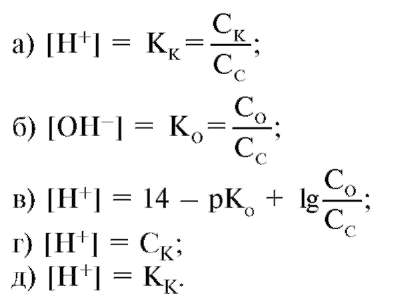






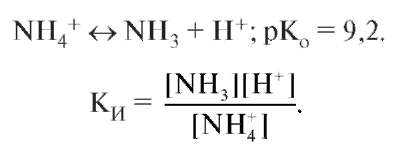



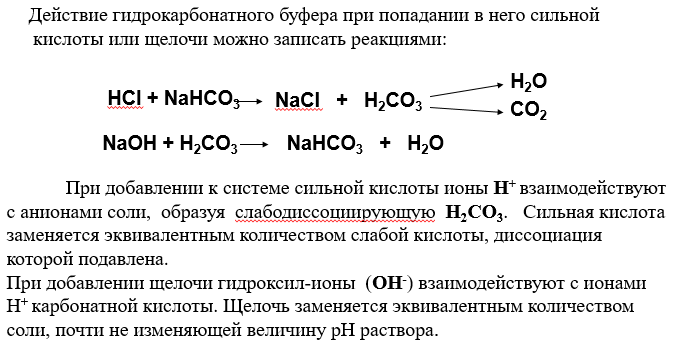
Рассмотрим механизм буферного действия. При добавлении к буферному раствору щелочи концентрация водородных ионов и рН изменяется также незначительно. В результате этого добавленная щелочь заменяется эквивалентным количеством слабоосновной соли, в меньшей — степени влияющей на реакцию среды.
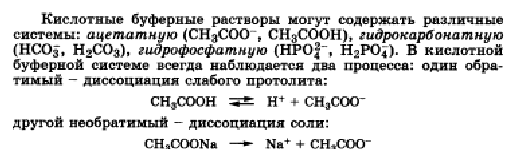
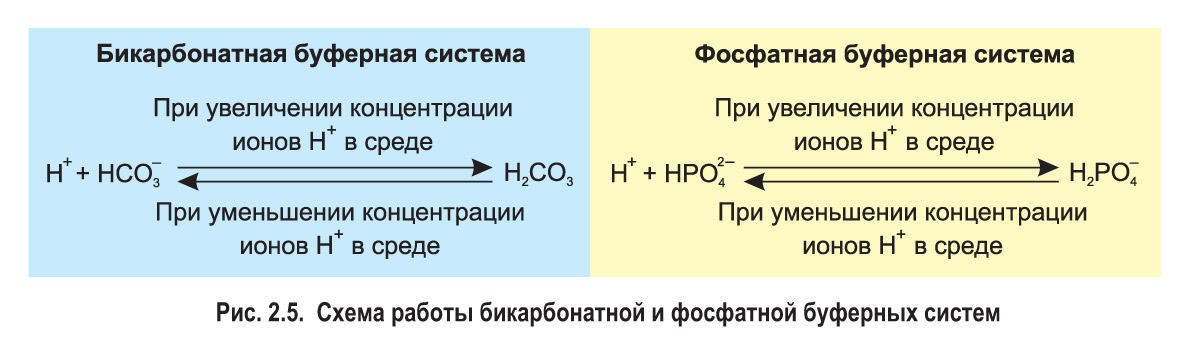




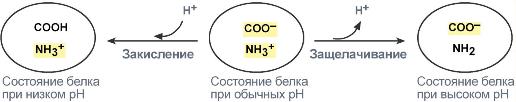
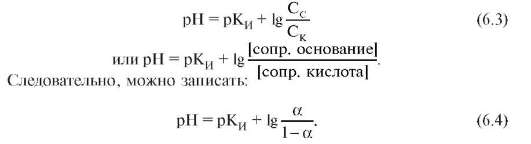

В растворе устанавливаются равновесия:. Каждое из этих равновесий характеризуется своей константой: первое — ионным произведением воды , второе — константой диссоциации кислоты. Значение pH буферных растворов можно рассчитать по уравнению Гендерсона :. Буферные растворы сохраняют своё действие только до определённого количества добавляемой кислоты, основания или степени разбавления, что связано с изменением концентраций его компонентов. Способность буферного раствора сохранять свой pH определяется его буферной ёмкостью — количеством сильной кислоты или основания, которые следует прибавить к 1 л буферного раствора, чтобы его pH изменился на единицу.